Environmental Engineering Reference
In-Depth Information
Teil A: Biopolymere aus der Natur
3
Proteine
Proteine, vom griechischen
proteuein
= „der erste sein“, bestehen aus
-Aminosäuren, mono-
mere chemische Verbindungen, die sowohl eine Aminogruppe als auch eine Carboxylgruppe
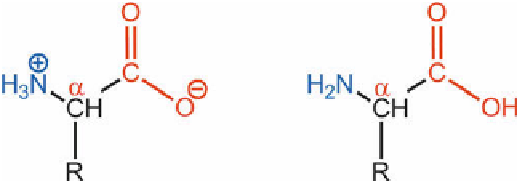
besitzen und der in Bild 61 gezeigten allgemeinen Strukturformel entsprechen [1], [2], [3].
α
Bild 61
Struktur von
-Aminosäuren. Dissoziierte Form (links) und undissoziierte Form (rechts).
Amino-
gruppe
und
Carboxylgruppe
befinden sich am
α
α
-Kohlenstoff.
In der Regel bilden 20 Aminosäuren, die sich durch den Rest R unterscheiden, die möglichen
Grundbausteine aller Proteine. Diese sind demnach Copolymere dieser Aminosäuren und damit
biogene Polyamide. Die Struktur des Restes R bestimmt die chemischen und physikalischen
Eigenschaften der einzelnen Aminosäuren; in Bild 62 sind die Aminosäuren in Gruppen nach
Polarität und Größe ihrer Seitenketten eingeordnet. Bei neutralem pH-Wert liegen die Amino-
säuren in Lösung als dipolare Ionen vor, d. h. die Aminogruppe ist protoniert und die Car-
boxylgruppe dissoziiert (siehe Bild 61). Die einfachste Aminosäure ist Glycin, das am
-Koh-
lenstoffatom, das der Carboxylgruppe benachbart ist, zwei Wasserstoffatome trägt. Sie ist
damit achiral, während alle anderen
α
-Aminosäuren chiral sind, also in zwei spiegelbildlichen
Formen, sogenannten D- und L-Enantiomeren vorkommen [4], [5], [6]. Bestandteil von Pro-
teinen sind nur die L-Aminosäuren [2], weswegen im Folgenden auf die Bezeichnung des
Enantiomeren verzichtet wird. Die Seitenketten R unterscheiden sich u. a. hinsichtlich Größe,
Form, Ladung, der Fähigkeit, Wasserstoffbrückenbindungen auszubilden und chemischer Re-
aktivität [2], so dass sich die Eigenschaften des Proteins als Folge der Aminosäurenzusammen-
setzung ergeben.
Wie bei vielen Biopolymeren existiert eine strukturelle Hierarchie: Die räumliche Anordnung
der Proteine ergibt sich in mehrstufiger Weise als Konsequenz dieser elementaren Aminosäu-
renzusammensetzung und Abfolge der Aminosäuren im Protein. Die Aminosäurenzusammen-
setzung und -abfolge bezeichnet man als Primärstruktur. Da keine freie Drehbarkeit um die
Peptidbindung (zwischen dem Kohlenstoff der Carboxylgruppe einer Aminosäure und dem
Stickstoff einer in der Kette benachbarten Aminosäure, siehe Bild 62) möglich ist, bestehen
Rotationsfreiheitsgrade nur um die beiden Bindungen am
α
α
-Kohlenstoff was Konsequenzen
für die möglichen Faltungen von Proteinen hat.
Search WWH ::

Custom Search