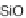Geology Reference
In-Depth Information
kommt, aber eine grobe Näherung für einen Basalt ist. Die Zu-
sammensetzung der Kristalle entspricht jeweils dem Rand des
Diagramms, die Gesamtzusammensetzung des Gesteins liegt
irgendwo dazwischen. Auch diesmal haben wir einen Liquidus
und einen Solidus. Die Temperatur, bei der der Liquidus auf die
Seitenränder des Diagramms trifft, entspricht dem jeweiligen
Schmelzpunkt des Minerals (genau genommen springt der
Solidus an den Rändern des Diagramms ebenfalls zum jewei-
ligen Schmelzpunkt). Auffällig ist der sogenannte eutektische
Punkt (Eutektikum): der niedrigste Punkt des Liquidus und zu-
gleich der Schnittpunkt von Liquidus und Solidus.
Wenn wir eine Schmelze der Temperatur und Zusammen-
setzung A abkühlen lassen, beginnt die Kristallisation auch
diesmal, sobald wir den Liquidus erreichen (Punkt B). Da wir
in das Zweiphasenfeld Anorthit + Schmelze kommen, kristal-
lisiert nun Anorthit (dessen Zusammensetzung am linken
Rand liegt). Welches Mineral als Erstes kristallisiert, hängt nicht
vom Schmelzpunkt des Minerals ab, sondern von der Zusam-
mensetzung der Schmelze! Beim weiteren Abkühlen kristal-
lisiert immer mehr Anorthit, während sich die Zusammenset-
zung der Schmelze entlang der Liquiduslinie verändert.
Schließlich erreichen wir das Eutektikum bei der »eutektischen
Temperatur« und mit einer verbliebenen Schmelze mit der
»eutektischen Zusammensetzung«. Je weiter die Gesamtzu-
sammensetzung (A) von der eutektischen Zusammensetzung
entfernt ist, desto mehr Restschmelze ist in diesem Moment
noch vorhanden. Diese kristallisiert bei der eutektischen
Temperatur vollständig zu Anorthit und Diopsid aus, sodass
wir ein Gestein entsprechend der ursprünglichen Gesamt-
zusammensetzung erhalten.
Diesmal endet eine fraktionierte Kristallisation zwangsläufig
beim eutektischen Punkt. Umgekehrt entsteht beim Auf-
schmelzen immer (sobald der Solidus erreicht ist) zunächst
eine Schmelze der eutektischen Zusammensetzung. Erst bei
höheren Temperaturen nähert sie sich der Ausgangszusam-
mensetzung an. Ein Sonderfall ist, wenn unser System bereits
die eutektische Zusammensetzung hat, diesmal wird bei
der eutektischen Temperatur das gesamte Gestein aufge-
schmolzen.
Ein Eutektikum gibt es auch, wenn wir ein Gestein mit mehr
als zwei Mineralen haben.
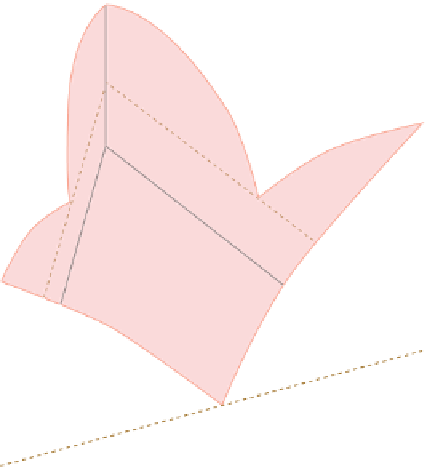
Abb. 3.11 zeigt ein System mit
drei Mineralen, womit wir schon nahe an natürliche Gesteine
kommen. Dabei sind drei dem vorhergehenden Beispiel ent-
sprechende eutektische Systeme zu einem Dreieck kombiniert.
Der Liquidus ist jetzt eine gewölbte Fläche mit drei Gipfeln,
dazwischen liegenden Tälern und einem an der tiefsten Stelle
liegenden ternären Eutektikum. Beim Abkühlen einer Schmel-
ze vom blauen Punkt kristallisiert als erstes Mineral A, die
Schmelze entwickelt sich »hangabwärts«, genau von Mineral A
weg. Mit Erreichen des »Talbodens« an der sogenannten kotek-
tischen Linie setzt die zusätzliche Kristallisation von Mineral B
ein. Das Mengenverhältnis der gleichzeitig kristallisierenden
Minerale ist von der Ausgangszusammensetzung abhängig.
Die Schmelze entwickelt sich nun »talabwärts« bis zum ternä-
ren Eutektikum, an dem alle drei Minerale gleichzeitig kristalli-
sieren. Umgekehrt entsteht beim Aufschmelzen eines Ge-
.
Abb. 3.12
Phasendiagramm Forsterit (Mg-Olivin) - Quarz bei
geringem Druck (0,1 MPa). Enstatit (Orthopyroxen) hat eine Zu-
sammensetzung zwischen beiden Mineralen. Neben einem Eu-
tektikum (E) gibt es in diesem System ein Peritektikum (P), an
dem Forsterit mit der Schmelze zu Enstatit reagiert. Auf der rech-
ten Seite des Diagramms gibt es ein Feld mit zwei nicht misch-
baren Schmelzen. Tridymit und Cristobalit sind Hochtemperatur-
phasen von SiO
2
.
Abb. 3.11
Schematisch: eutektisches System mit drei
Phasen A, B, C.
6