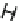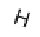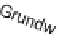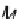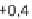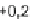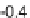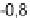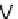Geoscience Reference
In-Depth Information
3
Abb. 63:
Häufig
vorkommende
E
H
/pH-Bedingun-
gen natürlicher
Wässer.
Wegen des Wasserüberschusses ist die Aktivität
von
c
(H
2
O) = 1, und da ln 1 = 0, entfällt der letz-
te Term der Gleichung, und es ist:
E
H
=
Redoxpotenzial der Lösung (V),
E
o
=
Standard-Redoxpotenzial (V)
(für T = 298 K, 10
5
Pa und
c
(ox) =
c
(red) = 1 mol/l Aktivität),
EE
RT
F
RT
F
R
=
universelle Gaskonstante = 8,314
(J/(mol · K)),
4
ln (O )
c
ln (H ) .
c
Ho
4
2
4
(Gl. 117)
T
=
absolute Temperatur (K),
=F
ARADAY
-Konstante = 96,484 · 10
3
(J/(V · mol)),
F
Da ln c(H
+
)
4
= 4ln c(H
+
) und definitionsgemäß
ln
c
(H
+
) = 2,3 lg
c
(H
+
) = -2,3 pH, ist im dekadi-
schen Logarithmus:
p
p
(X) =
Sauerstoff-Partialdruck (Pa).
Im
reduzierenden
Bereich (Elektronenaufnah-
me) ist die Stabilitätsgrenze des Wassers durch
die Reaktion:
2 H
2
O + 2 e
-
EE
RT
F
2,3
RT
F
2,3
lg (O )
c
pH.
Ho
4
2
(Gl. 117)
→
H
2
+ 2 OH
-
bzw.
2 H
+
+ 2 e
-
H
2
gegeben. Dafür lautet die pH-abhängige N
ERNST
-
Gleichung:
→
Bei Gasen geht jedoch statt der Aktivität der Par-
tialdruck
p
p
(X) dieses Gases ein, sodass sich
E
H
errechnet nach:
EE
RT
F
RT
F
23
,
lg
p
(
H
)
23
,
pH
EE
RT
F
23
,
RT
F
Ho
2
p
2
23
,
lg
p
p
(O
)
pH
Ho
2
4
Gl. 119
Gl. 118