Geoscience Reference
In-Depth Information
3
3.9.3.5 Kalk-Kohlensäure-
Gleichgewicht
"
Wird das Gas Kohlenstoffdioxid (CO
2
) in Wasser
(H
2
O) geleitet, löst es sich. Die Löslichkeit von
Gasen ist druck- und temperaturabhängig (Tab.
33).
Die wässrige Lösung von CO
2
reagiert sauer.
Ein sehr kleiner Anteil des gelösten CO
2
setzt sich
dabei nämlich in die schwache Kohlensäure um:
(!)!N%
"
"
@(!)!N%
"
(!)!N%
H
2
O + CO
2
i
H
2
CO
3
"
H
3
O
+
•
1. Dissoziationsstufe: H
2
CO
3
+ H
2
O
i
"
"
"
"
"
%I
+ HCO
3
-
Dissoziationskonstante
K
1
= 4,45 · 10
-7
mol/l
bei
N%$ !
ϑ =
25 °C
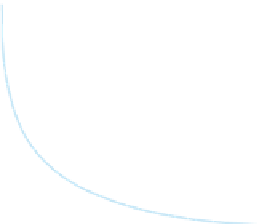
Abb. 61:
Abhängigkeit des Aktivitätskoeffizienten
f
von der Ionenstärke
I
(nach F
AIR
& G
EYER
, 1961).
2. Dissoziationsstufe: HCO
3
-
+ H
2
O
i
H
3
O
+
•
+ CO
3
2-
Dissoziationskonstante
K
2
= 4,69 · 10
-11
mol/l
bei
ϑ =
25 °C
Daraus resultiert z.B., dass in Meerwasser mehr
CaCO
3
als in reinem Wasser gelöst ist.
Die Gleichung nach D
EBYE
& H
ÜCKEL
(1923)
gilt für alle Ionen bis zu einer Ionenstärke von
etwa 0,1; das entspricht Konzentrationen von
etwa
Als zweiwertige Säure bildet die Kohlensäure zwei
Reihen von Salzen: Hydrogenkarbonate mit dem
HCO
3
-
-Anion und Karbonate mit dem CO
3
2-
-
Anion; letztere bilden sich im Grundwasser je-
doch nur bei Werten pH > 8,2. Hydrogenkarbo-
nate entstehen auch bei der Reaktion von Koh-
lensäure mit Karbonaten:
(CaSO
4
) =
3 400 mg/l in einem Temperaturbereich von
ϑ
β
(NaCl) = 6 000 mg/l oder
β
=
0 °C bis 40 °C. Die Abhängigkeit des Akti-
vitätskoeffizienten
f
von der Ionenstärke
I
für
Ionen verschiedener Wertigkeit
z
ist aus Abb. 61
ersichtlich (F
AIR
& G
EYER
, 1961).
Die Aktivitätskoeffizienten für gelöste Gase erge-
ben sich aus folgender Beziehung (M
ATTHEß
,
1994):
CO
3
2-
+ CO
2
+ H
2
O
i
2 HCO
3
-
Sie sind mit Ausnahme von NaHCO
3
leichter lös-
lich als Karbonate.
Cp
Cp
WD
sD,W
f
Gl. 102
Gas
Tab. 33:
Löslichkeit von Kohlenstoffdioxid in Wasser
in Abhängigkeit von Druck
p
und Temperatur
ϑ
.
f
Gas
=
Aktivitätskoeffizient für Gas (1),
Massen-
Luftdruck
Wasser-
p
D
=
Dampfdruck der Lösung bei der gege-
benen Ionenstärke (Pa),
konzentration
temperatur
β
(CO
2
)
p
ϑ
p
D,W
=
Dampfdruck des reinen Wassers (Pa),
mg/l
hPa
°C
C
W
=
Absorptionskoeffizient des Gases in rei-
nem Wasser (1/(hPa)),
3 346
1 013,24
0
C
s
=
Absorptionskoeffizient des Gases in der
Lösung bei der gegebenen Ionenstärke
(1/(hPa)).
2318
10
1 688
20
1257
30
32 200
24 511,68
20