Geoscience Reference
In-Depth Information
3
Tab. 28:
Einteilung von Stoffen nach ihrer Löslichkeit
in Wasser; Angaben als Massenanteil:
w
(X) (g wasser-
freier Stoff in 1 000 g Wasser).
"###
)I
Konzentrations-
Löslichkeit in
5##
bezeichnung
Wasser als Massen-
anteil w(X)
g/kg
6##
leicht lösliche Stoffe
> 100
7##
mäßig lösliche Stoffe
20 - 100
schwer lösliche Stoffe
1 - 20
8##
sehr schwer lösliche Stoffe
0,1 - 1
9##
praktisch unlösliche Stoffe
< 0,1
:##
/
3.9.3.2.1 Elektrolytische Dissoziation
4##
Bei der Auflösung eines Stoffes im Wasser werden
die Ionen eines Kristallgitters durch Wassermole-
küle getrennt und voneinander entfernt. Dieser
Vorgang, der durch die Bildung von elektrisch ge-
ladenen Ionen aus elektroneutralen Molekülen
gekennzeichnet ist, wird als
elektrolytische Dis-
soziation
bezeichnet. Stoffe, deren Moleküle im
Wasser mehr oder weniger in Ionen dissoziieren,
werden
Elektrolyte
genannt. Ursprünglich wur-
de der Begriff der elektrolytischen Dissoziation
auf alle Elektrolyte angewandt. Nach neueren
Auffassungen trifft er jedoch nur auf solche Stof-
fe zu, die erst aufgrund einer Reaktion mit Wasser
Ionen bilden (sog. potenzielle Elektrolyte). Im
Gegensatz dazu sind die natürlichen Elektrolyte
bereits in festem Zustand und in Schmelzen aus
Ionen aufgebaut, dazu gehören fast alle Salze. In
wässeriger Lösung liegen infolgedessen die natür-
lichen Elektrolyte vollständig ionisiert vor; die bei
Messungen der elektrischen Leitfähigkeit vorge-
täuschte unvollständige Ionisation ist durch in-
terionische elektrostatische Kräfte bedingt, die
eine Hemmung der Beweglichkeit der Ionen be-
wirken. Der wahre Dissoziationsgrad
$##
"##
:
$
$
#
$#
:#
8#
6#
"##G
(
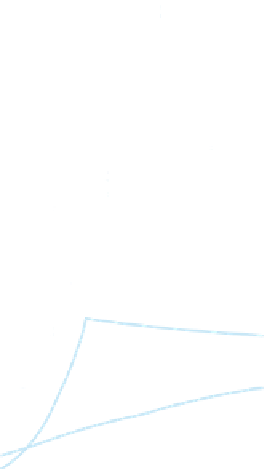
Abb. 60:
Temperaturabhängige Löslichkeit einiger
Salze im Wasser (Angaben als Massenanteil:
w
(X) ·100) (ergänzt nach A
LEKIN
, 1962).
lichkeit von festen Stoffen im Wasser auch von
dessen Temperatur ab; Beispiele zeigt die Abb. 60.
Bei Abkühlung scheidet ein Teil der gelösten Stof-
fe aus, bis das Gleichgewicht zwischen Kristallisa-
tion und Auflösung wieder erreicht ist.
Vielfach entstehen bei der Auflösung Hydrata-
tions-Zwischenprodukte und zwar dadurch, dass
die Kristallgitter nur zum Teil durch Wassermole-
küle gespalten und die Ionen der Salze von H
2
O-
Ionen umgeben werden. Solche Salz-Hydrate ha-
ben je nach Druck- und Temperaturbedingungen
andere Löslichkeiten als die hydratlosen Salze
(Tab. 29).
Zur größenordnungsmäßigen Ansprache der
Löslichkeit von Stoffen dienen die
Löslichkeits-
grade
, die jedoch in der Literatur nicht einheit-
lich angewandt werden. Eine Abstufung der Lös-
lichkeit von Stoffen gibt Tab. 28:
α
D
dissoziierte Moleküle
ursprünglich vorhandene Moleküle
Gl. 86
D
α
D
=
Dissoziationsgrad (1)
eines potenziellen Elektrolyten gibt an, welcher
Bruchteil des anfangs aus elektroneutralen Mole-