Environmental Engineering Reference
In-Depth Information
3.8
Elastin
Elastin ist wie Kollagen ein Skleroprotein und kommt vor allem in Gewebe vor, das eine hohe
Elastizität besitzen muss wie Blutgefäße, Lunge, Haut, Sehnen und der Gebärmutter [1]. Die
Aminosäurenzusammensetzung unterscheidet sich von der der Kollagene: Die wichtigsten
Aminosäuren sind Glycin (27 %), Alanin (23 %), Valin (17 %), Prolin (12 %) sowie Leucin
und Isoleucin (in Summe 12 %). Weiterhin sind Isodesmosin und Desmosin enthalten, die für
Elastin charakteristisch sind und für die Vernetzung der Proteinketten des Elastins aus 850-
870 Aminosäuren eine Rolle spielen [1]. Elastin besitzt eine fibrilläre und eine amorphe Kom-
ponente und ist darin der Seide vergleichbar [7].
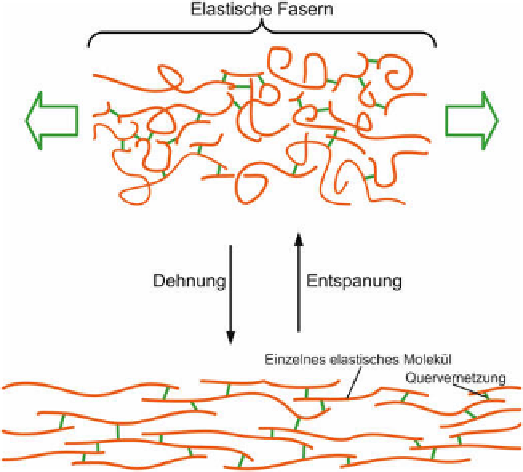
Elastin besitzt wie Kautschuk (siehe Kap. 6.1) Entropieelastizität [7], d. h. bei einer Verstre-
ckung wird eine Parallelanordnung der Moleküle und damit ein entropisch ungünstigerer Zu-
stand erreicht. Die Rückstellkraft führt beim Entspannen wieder zum entropisch günstigeren
ungeordneten Zustand (siehe Bild 101).
Bild 101
Entropieelastizität bei Elastin. Vergleiche dazu das Verhalten von Kautschuk (Bild 214
).
Elastin ist aufgrund seiner elastischen Eigenschaften potentiell interessant für das Tissue En-
gineering [54] von Arterien-Substituten. Auf diesem Gebiet wurde z. B. gezeigt, dass glatte
Muskelzellen von Pavianen, die auf tubulären Strukturen aus dem biologisch abbaubaren
Elastomer Poly-Glycerinsebazat (PGS) angesiedelt wurden, innerhalb von drei Wochen im
ganzen Umfang mit Proteinen der extrazellulären Matrix, darunter auch Elastin, besiedelt wor-
den sind. Der Elastinanteil betrug 19 % dessen, was in nativen Arterien beobachtet wird. Die
prototypischen künstlichen Arterien besaßen einen Berstdruck von 200 mm Quecksilbersäule
und waren verträglich mit nativen Arterien. Darüber hinaus entsprach die Orientierung der
Elastinfasern in der künstlichen Struktur der in nativen Arterien [136].

Search WWH ::

Custom Search