Geology Reference
In-Depth Information
freiem Quarz. Die Löslichkeit von Quarz selbst
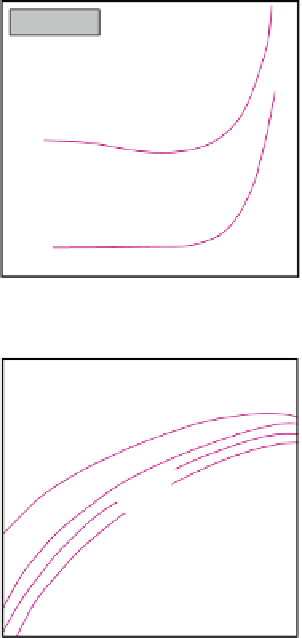
in Wasser steigt mit zunehmender Temperatur
und mit zunehmendem pH-Wert (Abb. 3.170).
Auch die
Calcitlöslichkeit
in wässrigen Fluiden
hängt im Wesentlichen vom pH-Wert ab, dane-
ben aber auch von der CO
2
-bzw.HCO
3
-
-Kon-
zentration, wobei letztere auch wieder über ein
pH-abhängiges Gleichgewicht miteinander ver-
bunden sind. Am einfachsten zeigen dies zwei
Reaktionsgleichungen:
2CaCO
3
+2H
+
=2Ca
2+
+2HCO
3
-
HCO
3
-
+H
+
=CO
2
+H
2
O
Dies bedeutet, dass bei pH-Absenkung (was
ja einer höheren H
+
-Ionenkonzentration ent-
spricht) Calcit aufgelöst und in Hydrogencarbo-
nationen und CO
2
umgewandelt wird. Die Ca
2+
-
Ionen verbleiben dissoziiert im Wasser. Bei pH-
Anhebung dagegen wird nach dem Prinzip von
LeChatelier bzw. einfach gemäß der Gleichge-
wichtskonstanten Calcit ausgefällt. Abb. 3.173
zeigt den Vergleich der SiO
2
und CaCO
3
-Löslich-
keit in Wasser in Abhängigkeit vom pH-Wert.
Ganz offensichtlich gibt es unterschiedliche Be-
(a)
5000
1 bar, 25 °C
2000
1000
500
200
amorphes SiO
2
100
50
20
10
5
Quarz
0
2
4
6
8
10
12
pH
(b)
5000
2000
1000
500
200
100
50
20
10
5
0
50
100
150
200
250
300
350
Temperatur (°C)
(c)
1
0
p = 210 bar
-1
0,1
amorphes
SiO
2
-2
0,01
H
4
SiO
4
-3
150°C
0,001
100°C
-4
50°C
1 bar, 25 °C
0,0001
-5
2
4
6
8
10
12
5
6
7
8
9
10
11
12
13
pH
pH
3.170
Die Löslichkeit von SiO
2
-PhaseninWasser
in Abhängigkeit von Temperatur und pH-Wert. In
(c) geht es um Tiefquarz. Nach Füchtbauer (1988)
und Staude et al. (2007).
3.171
Löslichkeit von SiO
2
in Wasser bei 25°C
und 1 bar sowie die Bedeutung der einzelnen Si-
haltigen Spezies für die Erhöhung der Löslichkeit
bei steigendem pH-Wert. Im grauen Feld ober-
halb der roten Kurve fällt amorphes SiO
2
aus. Aus
Dove & Rimstidt (1994).