Geology Reference
In-Depth Information
wirktaberledig ichkatalytisch.Wirhaben
schon mehrere solcher Reaktionen kennen
gelernt, die obigen Phasentransformationen
sind ein Teil davon. Auch die Reaktion von
Mg
2
SiO
4
zu Mg-Si-Perowskit und Magnesio-
wüstit ist eine Festphasenreaktion. All diese
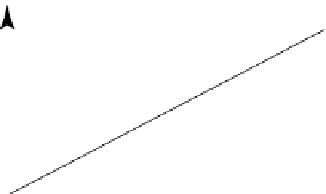
Festphasenreaktionen haben konstante Stei-
gungen in p-T-Diagrammen (sind also gerade
Linien).DiegeometrischeAnordnungdieser
univarianten Kurven auf einem Phasendia-
gramm ist strikten Regeln unterworfen
(
Schreinemakers-Regeln
). Diese Regeln erlau-
benesallerdingsnicht,SteigungenvonKurven
in Phasendiagrammen zu berechnen. Dazu be-
nötigt man die
Clausius-Clapeyron-Gleichung
(Kasten 3.7). Reaktionen ohne fluide Phasen
sind immer Geraden in
p-T
-Diagrammen, da
die Änderung der Entropie und die Änderung
Kasten 3.7
Die Clausius-Clapeyron-Gleichung
Die Clausius-Clapeyron-Gleichung beschreibt
in einem
p-T
-Diagramm die Steigung jeder
Reaktionskurve (Abb. 3.17). Sie lautet
d
p
=
¿
S
¿
V
wobei dp/dT die Ableitung des Druckes nach
der Temperatur, also die Steigung ist, ¿
S
die
die Änderung der Entropie durch eine Mine-
ralreaktion und ¿
V
die Änderung des Ge-
samtvolumens der Mineralvergesellschaf-
tung. Die
Entropie
ist eine mit Energien ver-
wandte Größe (ihre Einheit ist J/mol), die ein
Maß der Unordnung in einer Substanz dar-
stellt. Je größer die Entropie, desto ungeord-
neter ist ein System. Jedes Mineral hat pro
Mol Substanz eine bestimmte Entropie und
ein bestimmtes Volumen, und diese Werte
für
S
und
V
sind für die meisten wichtigen ge-
steinsbildenden Minerale tabelliert. ¿
S
und
¿
V
werden dann nach der Regel „Summe
der Entropien oder Volumina der Produkte
einer Reaktion minus Summe der Entropien
oder Volumina der Edukte einer Reaktion“
berechnet. Für Einkomponentensysteme ist
dies sehr einfach. Betrachten wir z.B. die Re-
aktion von Hochquarz nach Tiefquarz:
d
T
3.17
Festphasenreaktionen wie z.B. Albit = Ja-
deit + Quarz bilden Geraden konstanter Stei-
gung in
p-T
-Diagrammen.
2CaSiO
3
+CaAl
2
Si
2
O
8
=Ca
3
Al
2
Si
3
O
18
+SiO
2
2 Wollastonit + Anorthit (Komp. in Feldspat)
= Grossular (Komp. in Granat) + Quarz
In diesem Fall ist die Volumenänderung der
Reaktion ¿
V
=
V
Grs
+
V
Qz
-2·
V
Wo
-
V
An
,die
Entropieänderung ist ¿
S
=
S
Grs
+
S
Qz
-2·
S
Wo
-
S
An
. Man beachte den stöchiometrischen
Koeffizienten vor Wollastonit! Mit den ta-
bellierten Werten für
S
und
V
kann man
dann die Steigung dieser Reaktionskurve in
einem
p-T
-Diagramm berechnen:
Tiefquarz
S
= 41,259 J/(K · mol),
V
= 2,2688 J/(bar · mol)
Hochquarz
S
=44,007J/(K·mol),
V
= 2,3352 J/(bar · mol)
1 Steigung d
p
/d
T
= (41,259 - 44,007)/
(2,2688 - 2,3352) = 41,39 bar/K
S
Grs
=255,15 J/(K·mol)
V
Grs
=12,538 J/(bar ·mol)
S
Qz
=41,25 J/(K·mol)
V
Qz
=2,269 J/(bar·mol)
S
Wo
=81,81 J/(K·mol)
V
Wo
=3,983 J/(bar·mol)
S
An
=200,18 J/(K·mol)
V
An
=10,075 J/(bar ·mol)
In Mehrkomponentensystemen ist es meist
komplizierter. So kann man z.B. für fol-
gende Reaktion die ¿
S
-und ¿
V
-Werte be-
rechnen:
Es folgt, dass ¿
V
=-3,234 J/(bar · mol),
¿
S
=-67,4 J/(K · mol) und daher
d
p
/d
T
=20,84 bar/K ist.