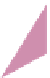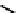Geology Reference
In-Depth Information
vitätsdiagramme bei unterschiedlichen Dru-
cken und Temperaturen (entlang eines geother-
mischen Gradienten) gezeigt sind. Man sieht,
dass die isotherm und isobar divarianten Fel-
der der Festphasen durch isotherm und isobar
univariante Linien, Reaktionslinien, voneinan-
der getrennt sind. Ob also K-Feldspat oder
Muksovit stabil ist, hängt davon ab, ob man
sich rechts oder links der Linie befindet, die
das Muskovit- und das K-Feldspat-Feld vonein-
ander trennen. Man hat natürlich die Freiheit,
die Variablen zu wählen, die man für seine spe-
zielle Fragestellung am geeignetsten hält. In
unserem Fall könnten dies also z. B. K
+
gegen
H
+
-oderAl
3+
gegen H
+
-Diagramme sein. Aller-
dingsstelltmanhäufigfest,dassmaneigent-
lich noch mehr Variabeln auftragen möchte,
z. B. weitere Fluidspezies oder auch den Druck,
die Temperatur oder eben den oben erwähnten
Eh-Wert. Daher hat es sich eingebürgert, Katio-
nenaktivitäten immer im Verhältnis zu H
+
-Io-
nenaktivitäten, also zum pH-Wert anzugeben,
da somit eine Achse „freigemacht“ wird für ei-
nen anderen Parameter, und kaum Information
verloren geht. Aber wohlgemerkt: dies ist Kon-
vention, aber nicht verpflichtend! Jeder kann
das für seine Bedürfnisse optimale Diagramm
konstruieren und Abb. 3.15 zeigt, dass biswei-
len auch dreidimensionale Diagramme kon-
struiert werden, um spezielle Probleme zu be-
trachten. Ebenfalls Konvention ist es, die Spezi-
esaktivitäten oder -Verhältnisse logarithmisch
aufzutragen.
In unserem Fall der Abb. 3.14 ist es offenbar
sinnvoll, neben pH-Wert und Al
3+
-Ionenaktivi-
tät auch noch die SiO
2
-Aktivität (die der Menge
an im Fluid gelöstem SiO
2
proportional ist) an-
zugeben, da nicht alle Gesteine Quarz-gesättigt
sind. Die Quarzsättigung ist in solchen Dia-
grammendannalssenkrechteLinieeingetra-
gen,dasieunabhängigvonpH-Wertodersons-
tigen Ionenkonzentrationen ist. Interessanter-
weise tritt die Quarzsättigung bei geringeren
SiO
2
-Aktivitäten im Fluid auf als die Sättigung
-3
6
-4
5
-5
-6
4
-7
3
2
-3
-3
-4
-4
-5
-5
-6
-6
-7
-7
-8
-8
3.15
Dasselbe chemische Sys-
tem wie in Abb. 3.14 wird hier
dreidimensional, also in Ab-
hängigkeit dreier unterschied-
licher Variablen gezeigt, näm-
lich der Al
3+
-Aktivität, der Kie-
selsäure-Aktivität und dem pH-
Wert. Nach Garrels & Christ
(1965).
6
5
-3
-4
4
-5
3
-6
-7
2