Geology Reference
In-Depth Information
Kasten 2.3
Elektronegativitäten nach Pauling
Atom
Elektronegativität
Atom
Elektronegativität
H
2,20
C
2,55
O
3,44
F
3,98
Na
0,93
Mg
1,31
Al
1,61
Si
1,90
S
2,58
Cl
3,16
K
0,82
Ca
1,00
Kasten 2.4
Berechnung von Grenzwerten für Ionenkoordination
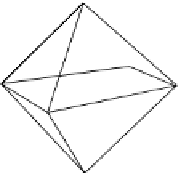
Beispiel für die oktaedrische Koordination:
In einem gleichschenkligen, rechtwinkligen
Dreieck, dessen Katheten zweimal dem
Radius des Sauerstoffs entsprechen, dessen
Hypotenuse dagegen 2 · Radius(Anion) + 2 ·
Radius(Kation) ist (siehe Abb. 2.18), gilt nach
P
yt
hagoras: Radius(Kation) = Radius(Anion) ·
' 2 - Radius(Anion). Das Verhältnis von
K
at-
ionen- zu Anionenradius ist demnach ' 2 -1
= 0,41, wenn sich die Sauerstoffatome ge-
rade berühren. Dies bedeutet, dass das Kat-
ion nicht kleiner sein dürfte, denn näher zu-
sammenrücken können die Sauerstoffatome
ja nicht mehr. Anders ausgedrückt: wenn Ra-
dius(Kation)/Radius(Anion)
X
0,41, dann ist
das Kation vierfach koordiniert, ist das Ver-
hältnis größer, ist es sechsfach koordiniert.
Ähnlich kann man mit allen regelmäßigen
Koordinationspolyedern verfahren.
2
•
r
A
Koordination
R(Kation)/R(Anion)
1,0
1,0 - 0,732
0,732 - 0,414
0,414 - 0,225
0,225 - 0,155
< 0,155
12-fach
8-fach
6-fach
4-fach
3-fach
2-fach
2.18
Grenzradien-Verhältnisse für Ionen in verschiedenen Koordinationen. Oben ist als Beispiel
gezeigt, wie man das Grenzradien-Verhältnis für die oktaedrische Koordination ausrechnen kann.
derKarbonationendurchkovalenteBindungen
zusammengehalten, während Karbonat- und
Ca
2+
-Ionen ionisch verbunden sind. Will man
den Bindungstyp in Zahlen ausdrücken, so
kommt das Konzept der
Elektronegativität
zum Tragen. Die Elektronegativität ist das Ver-