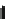Environmental Engineering Reference
In-Depth Information
a
b
c
2H
2
O
2
H
2
O
2
+
−
0.5
4H
+
−
+
2H O
2
H
2
O
2
+4e
−
−4e
−
H
+
SO
−−
O
2
2H
2
2O
−
−
−
+
H
2
O +
H
2
SO
4
2H O
2
H
2
+4e
−
−4e
−
Katalysator
Abb.8.7
a
zeigtdenprinzipiellen Aufbaueiner Elektrolysezelle mit flüssigemElektrolyten undH
O
als
Katalysator
.In
c
ist eine äquivalente Zelle mit Feststoffelektrolyten (Polymermembran) und Me-
tallkatalysatoren zu sehen. In
b
sinddieReaktionsabläufeineinemsaurenFeststoffelektrolyten(
oben
)
und in einem basischen Feststoffelektrolyten (
unten
) zu sehen
Dass derartige Verfahren noch nicht in der Energieversorgung eingesetzt werden, hat viele
Gründe, einer ist sicherlich, dassdie chemischen Bestandteile bei den hohenTemperaturen
sehr aggressiv sind und spezielle Materialien für den Reaktor entwickelt werden müssen.
Falls es nicht gelingt, Wasser allein thermisch zu spalten, muss die Spaltung nach
Abb.
8.6
elektrisch unterstützt werden. Grundlage dafür bildet die
Wasserelektrolyse
,
man spricht, je nach Verfahrenstemperatur, von einer Hochtemperatur- bzw. Niedertem-
peratur-Elektrolyse. Bevor wir uns den modernen Verfahren zuwenden, soll das Prinzip
an einem einfachen und seit langem bekannten Beispiel erläutert werden, der Elektrolyse
in wässriger Schwefelsäure.
Bei diesem Elektrolyseverfahren fließt ein elektrischer Strom durch einen wässrigen
Elektrolyten, wobei sich an den Elektroden Wasserstoff und Sauerstoff abscheiden. In dem
gewählten Beispiel ist der Elektrolyt mit Schwefelsäure (H
SO
) angesäuertes Wasser, in
das zwei Platinelektroden ragen. Der prinzipielle Aufbau und die ablaufenden Reaktionen
sind in Abb.
8.7
gezeigt. Schwefelsäure dissoziiert in wässeriger Lösung in die Anionen
SO
−−
und die Kationen H
+
. Das Wasser fungiert als Katalysator, der aus einem ungelade-
nen chemischen Bestandteil zwei geladene Ionen erzeugt. Der Strom durch den Elektroly-
ten wird von den wandernden An- und Kationen erzeugt. Die Kationen neutralisieren an
der Kathode zu H
, die Anionen bilden an der Anode mit dem Wasser wiederum H
SO
,
wobei neutraler Sauerstoff O
entsteht. Im Wesentlich handelt es sich bei der Wasserelek-
trolyse um die Reaktion
H
+
+
O
−−
→
H
O
→
H
+
,O
.
(8.60)
Bei modernen Verfahren werden meist keine flüssigen
Elektrolyte
mehr verwendet,
sondern Feststoffelektrolyte, die je nach dem Ionentyp, für den sie leitend sind, entwe-